Основные материалы и их соединения в строительстве
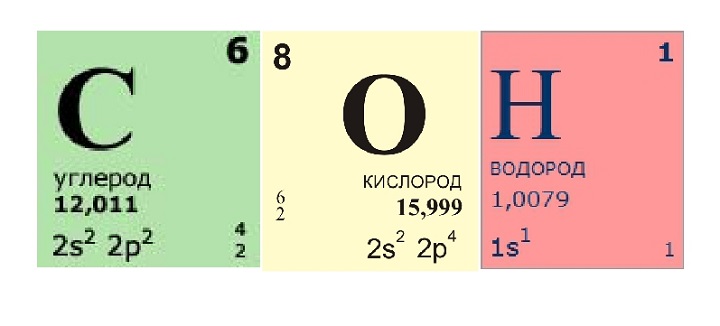
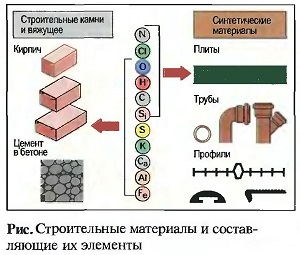
Большинство строительных материалов — это смеси из различных химических соединений, которые, в свою очередь, состоят из элементов. Наряду с элементами углеродом (С), водородом (Н) и кислородом (О) строительные материалы и вяжущие содержат калий (Ка), кальций (Са), кремний (Si), алюминий (Аl) и железо (Fe). Синтетические материалы в основном содержат хлор (Сl) и азот (N) (рис.»Строительные материалы и составляющие их элементы»).
Кислород (О)
СВОЙСТВА: Кислород без запаха, без вкуса, бесцветный газ тяжелее воздуха. Он необходим для горения и для дыхания, но сам не горит. В чистом кислороде сгорают многие вещества, даже металлы, быстро и полностью.
 |
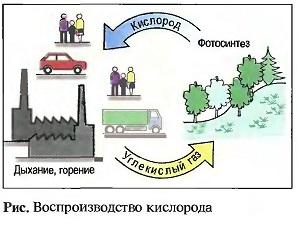 |
ПРОИСХОЖДЕНИЕ: почти 21 % воздуха составляет свободный кислород. Большая часть кислорода содержится в каменной массе земной коры и в воде в химически связанном состоянии. Кислород выделяется растениями с помощью фотосинтеза из углекислого газа (рис. «Воспроизводство кислорода»).
ПРИМЕНЕНИЕ: Кислород применяется при сварке и резке металлов, для производства стали и в качестве кислородного разделителя бетона и заполнителя.
Окисление, Восстановление (раскисление)
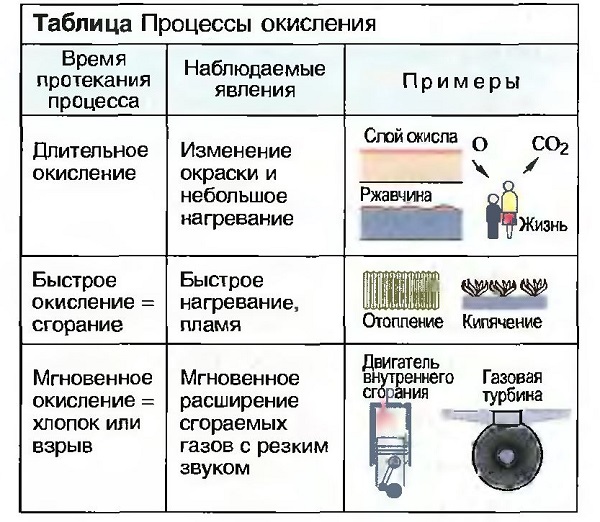
Когда вещество соединяется с кислородом, то говорят об окислении, а возникшее при этом вещество называют оксидом или окислом. При любом окислении выделяется тепло. 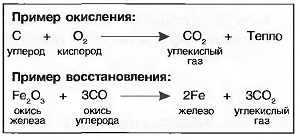 Окисление может происходить быстро или медленно по времени (табл. «Процессы окисления»).
Окисление может происходить быстро или медленно по времени (табл. «Процессы окисления»).
Если у окисла отнимается кислород, то говорят о восстановлении (раскислении). Для раскисления необходимо тепло. Получение многих металлов из их руд происходит путем восстановления.
Водород (Н)
СВОЙСТВА: Водород — бесцветный газ без запаха. Он является самым легким из всех веществ. 1 литр весит 0,09 г. Смесь водорода и кислорода в соотношении 2:1 очень взрывоопасна.
ПРОИСХОЖДЕНИЕ: Водород в чистом виде в природе не встречается, однако в химически связанном виде он присутствует во многих ископаемых горючих веществах и в воде. Необходимый для промышленности водород получается из нефти или природного газа.
ПРИМЕНЕНИЕ: Водород находит применение в химической промышленности и в сварочной технике.
Углерод (С)
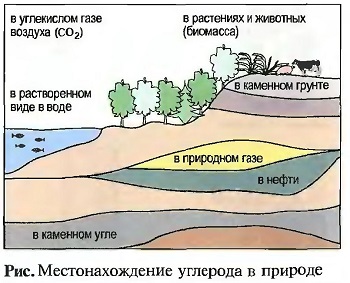
ПРОИСХОЖДЕНИЕ: Углерод в природе в чистом виде встречается в виде графита и алмаза. В химически связанном виде он присутствует в каменных частях земной коры, например, в виде известняка (СаСО3), и в растительных остатках, например в каменном угле, в нефти и природном газе. Наряду с этим он является составной частью биомассы растений и животных. В виде углекислого газа он присутствует в воздухе и находится в растворенном виде в воде (рис. «Местонахождение углерода в природе»).
СВОЙСТВА: Графит — это мягкое, черное, блестящее красящее вещество. Алмаз бесцветен, стекловиден, очень тверд и хрупок.
 |
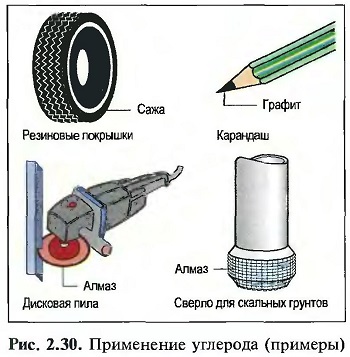 |
ПРИМЕНЕНИЕ: технически полученный углерод служит коксом для получения железа, сажей для наполнителя при производстве резины, в качестве углеродных волокон для упрочнения пластмасс и в качестве алмазов для обкладки сверл по камню. Алмаз в порошковой форме применяется в
качестве шлифовального средства, например для дисковых пил, или в качестве полировального средства (рис. «Применение углерода»).
Соединения углерода
Различают неорганические и органические соединения углерода. К неорганическим относятся угарный газ (СО), углекислый газ (С02), углекислота и ее соли, а также карбиды (рис. «Важнейшие соединения углерода»).
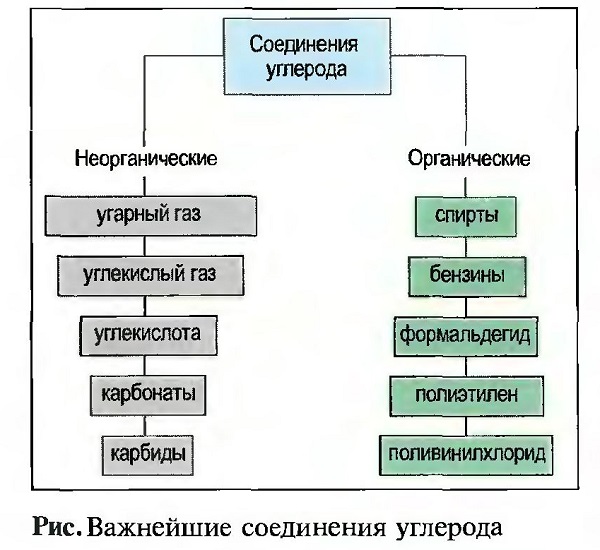
Неорганические соединения углерода
УГАРНЫЙ ГАЗ (СО) получается при сжигании углеродосодержащих материалов при недостаточном снабжении кислородом. Это бесцветный газ без запаха. Он очень ядовит и горит синим пламенем. Он используется в большой технике для производства многих материалов, например пластмасс и растворителей.
УГЛЕКИСЛЫЙ ГАЗ (СO2) получается при сжигании углеродосодержащих материалов. Это негорючий, бесцветный газ без запаха. Он не ядовит. Так как он почти в 1,5 раза тяжелее воздуха, он собирается в низких местах, например в подвалах и шахтах. Там имеется опасность задохнуться!
- Выделяющийся в больших количествах при сжигании ископаемых горючих материалов, например нефти и газа, углекислый газ ведет к нагреванию атмосферы (к созданию так называемого парникового эффекта в атмосфере Земли).
- Двуокись углерода в воздухе является причиной «кислотных дождей».
- Угарный газ вызывает отравление людей. Находясь в атмосфере углекислого газа, человек может задохнуться.
Органические соединения углерода
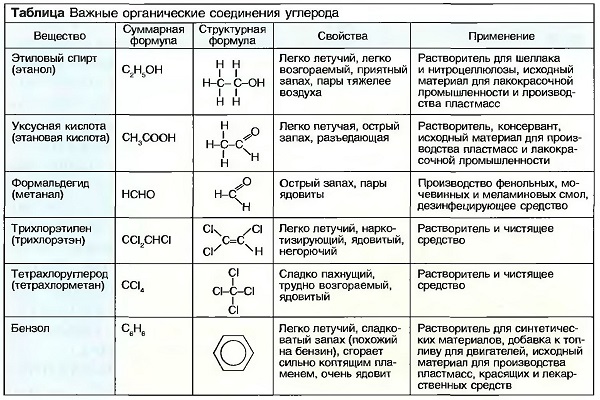
Важными соединениями углерода являются УГЛЕВОДОРОДЫ. По строению их молекул различают цепные, кольцеобразные, а также разветвленные углеводороды.  В цепных углеводородах атомы углерода располагаются в ряд друг за другом, а свободные валентности заняты атомами кислорода (рис. «Цепные углеводороды»). Цепи углеводородов, содержащие до 5 атомов С, — газообразны, например газ пропан С3Н8, с 6 до 15 атомов — жидкие, например октан С8Н18, и с 15 атомов С и более — пастообразные, до твердых, например, стеарин С18Н36. Бензин — это смесь жидких углеводородов. Атомы углерода могут соединяться друг с другом посредством 2 или 3 валентностей. Их называют НЕНАСЫЩЕННЫМИ. Ненасыщенными углеводородами являются, например, газы ацетилен и этилен (рис. «Ненасыщенные углеводороды»). Простейшим кольцеобразным соединением углеводородов является бензол С6Н6. Другим производным соединением из бензола является фенол С6Н5ОН (рис. «Кальцеобразные углеводороды»). Кольцеобразные ненасыщенные углеводороды являются важными исходными материалами для химической промышленности, например для производства пластмасс. Другими органическими соединениями углерода, содержащими наряду с водородом еще и другие химические элементы, такие, как, например, кислород, хлор и азот, являются спирты (алканолы), альдегиды (алканалы), органические кислоты (спиртовые кислоты) и хлорированные углеводороды (табл. «Важные органические соединения углерода»).
В цепных углеводородах атомы углерода располагаются в ряд друг за другом, а свободные валентности заняты атомами кислорода (рис. «Цепные углеводороды»). Цепи углеводородов, содержащие до 5 атомов С, — газообразны, например газ пропан С3Н8, с 6 до 15 атомов — жидкие, например октан С8Н18, и с 15 атомов С и более — пастообразные, до твердых, например, стеарин С18Н36. Бензин — это смесь жидких углеводородов. Атомы углерода могут соединяться друг с другом посредством 2 или 3 валентностей. Их называют НЕНАСЫЩЕННЫМИ. Ненасыщенными углеводородами являются, например, газы ацетилен и этилен (рис. «Ненасыщенные углеводороды»). Простейшим кольцеобразным соединением углеводородов является бензол С6Н6. Другим производным соединением из бензола является фенол С6Н5ОН (рис. «Кальцеобразные углеводороды»). Кольцеобразные ненасыщенные углеводороды являются важными исходными материалами для химической промышленности, например для производства пластмасс. Другими органическими соединениями углерода, содержащими наряду с водородом еще и другие химические элементы, такие, как, например, кислород, хлор и азот, являются спирты (алканолы), альдегиды (алканалы), органические кислоты (спиртовые кислоты) и хлорированные углеводороды (табл. «Важные органические соединения углерода»).
РЕКОМЕНДУЮ ЕЩЕ ПОЧИТАТЬ: