Коррозия металлов

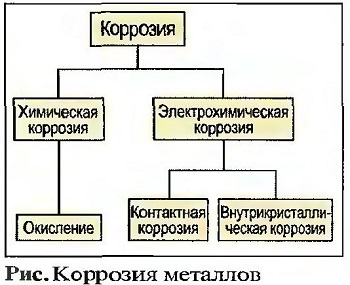 Под коррозией понимают изменение материалов за счет химических или электрохимических процессов. Степень коррозии зависит во многом от того, будут ли материалы окружены, например, более или менее влажным воздухом (погодная коррозия) либо морской или агрессивной водой (рис. «Коррозия металлов»).
Под коррозией понимают изменение материалов за счет химических или электрохимических процессов. Степень коррозии зависит во многом от того, будут ли материалы окружены, например, более или менее влажным воздухом (погодная коррозия) либо морской или агрессивной водой (рис. «Коррозия металлов»).
Кроме меди, все не содержащие железа металлы подвержены агрессивному воздействию свежего раствора и бетона. Поэтому они должны защищаться покраской или оклейкой бумагой или фольгой так долго, пока раствор или бетон не затвердеет.
Химическая коррозия
 Многие металлы химически изменяются на поверхности за счет окисления кислородом. Кроме того, при этих процессах химически могут действовать жидкости (вода, кислоты, щелочи, растворы солей), газы или пары. Высокие температуры ускоряют процесс коррозии.
Многие металлы химически изменяются на поверхности за счет окисления кислородом. Кроме того, при этих процессах химически могут действовать жидкости (вода, кислоты, щелочи, растворы солей), газы или пары. Высокие температуры ускоряют процесс коррозии.
При окислении меди, цинка, свинца или алюминия возникает на поверхности плотная, трудно разрушаемая пленка оксида, защищающая эти металлы от дальнейшей коррозии (рис. «Коррозия путем окисления»).
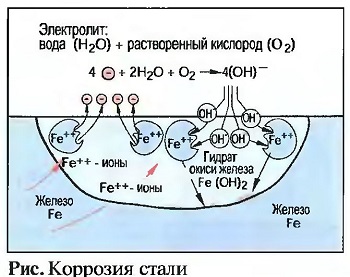 Железные материалы при химической коррозии на влажном воздухе образуют гидрат окиси железа FeO (OH). Отсюда возникает при дальнейших химических процессах образование ржавчины стали. Ржавчина — это рыхлый пористый слой, который не обеспечивает никакой защиты от дальнейшей коррозии (рис. «Коррозия стали»).
Железные материалы при химической коррозии на влажном воздухе образуют гидрат окиси железа FeO (OH). Отсюда возникает при дальнейших химических процессах образование ржавчины стали. Ржавчина — это рыхлый пористый слой, который не обеспечивает никакой защиты от дальнейшей коррозии (рис. «Коррозия стали»).
Благородные металлы, как, например, золото и серебро, особенно устойчивы против химической коррозии. Чем более благородным является металл, тем менее он подвержен коррозии.
Электрохимическая коррозия
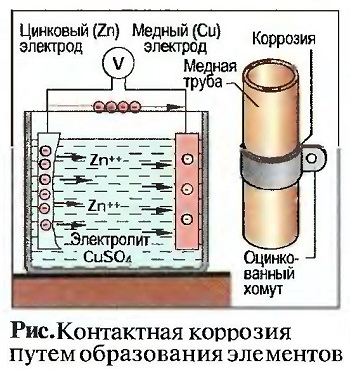 При электрохимической коррозии электропроводящая жидкость (электролит) должна находиться между двумя различными металлами. Электролитами являются, например, дождевая вода, влажность воздуха или пот на ладони. При электрохимической коррозии происходят процессы, похожие на процессы в гальваническом элементе. Гальванический элемент состоит из двух различных материалов, представляющих собой электроды, например медный лист и цинковый лист, и электролита, например сульфата меди (CuS04) (рис. «Контактная коррозия путем образования элементов»). В этом элементе возникает электрическое напряжение между листом меди (положительный полюс) и листом цинка (отрицательный полюс).
При электрохимической коррозии электропроводящая жидкость (электролит) должна находиться между двумя различными металлами. Электролитами являются, например, дождевая вода, влажность воздуха или пот на ладони. При электрохимической коррозии происходят процессы, похожие на процессы в гальваническом элементе. Гальванический элемент состоит из двух различных материалов, представляющих собой электроды, например медный лист и цинковый лист, и электролита, например сульфата меди (CuS04) (рис. «Контактная коррозия путем образования элементов»). В этом элементе возникает электрическое напряжение между листом меди (положительный полюс) и листом цинка (отрицательный полюс).
Цинк, как метал «минусового» полюса, разлагается. В качестве «плюсового» полюса медь остается целой. Гальванические элементы можно составлять также и из других металлов. Одинаковые металлы не создают напряжения.
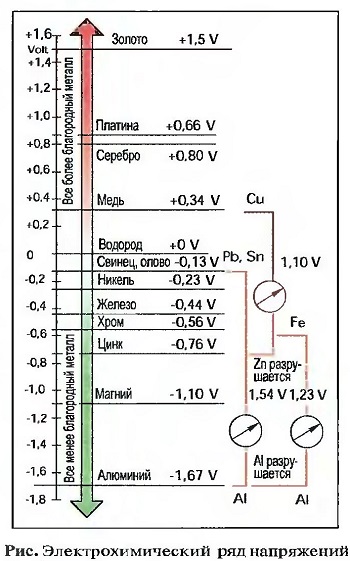 В зависимости от применяемых материалов можно получать различные высокие электрические напряжения. Если сравнивать металлы с электрически нейтральным водородом, то оказывается, что между водородом и некоторыми металлами возникает различное по величине электрическое напряжение. Эти различия в напряжении можно представить в виде ряда напряжений (рис. «Электрохимический ряд напряжений»). С помощью ряда напряжений можно рассчитать напряжения для каждого гальванического элемента. Элемент из меди и цинка создает, например, 1,10 В. Металлы, которые образуют положительные полюса, — это более благородные металлы, а те, которые образуют отрицательные полюса, — это менее благородные металлы. Чем больше расстояние между металлами и водородом в ряду напряжений, тем более благородным или тем менее благородным является металл. Чем дальше оба металла гальванического элемента лежат друг от друга в ряду напряжений, тем быстрее разрушается неблагородный металл. При электрохимической коррозии различают контактную коррозию и внутрикристаллическую коррозию.
В зависимости от применяемых материалов можно получать различные высокие электрические напряжения. Если сравнивать металлы с электрически нейтральным водородом, то оказывается, что между водородом и некоторыми металлами возникает различное по величине электрическое напряжение. Эти различия в напряжении можно представить в виде ряда напряжений (рис. «Электрохимический ряд напряжений»). С помощью ряда напряжений можно рассчитать напряжения для каждого гальванического элемента. Элемент из меди и цинка создает, например, 1,10 В. Металлы, которые образуют положительные полюса, — это более благородные металлы, а те, которые образуют отрицательные полюса, — это менее благородные металлы. Чем больше расстояние между металлами и водородом в ряду напряжений, тем более благородным или тем менее благородным является металл. Чем дальше оба металла гальванического элемента лежат друг от друга в ряду напряжений, тем быстрее разрушается неблагородный металл. При электрохимической коррозии различают контактную коррозию и внутрикристаллическую коррозию.
Контактная коррозия
Если различные металлы без изолирующего промежуточного слоя привести в контакт с электролитом, то за счет соприкосновения металлов возникает контактная коррозия. Если медную трубу, например, прикрепить оцинкованным хомутом к стене, то на влажном воздухе или при дожде хомут будет разрушен
контактной коррозией. Поэтому друг с другом должны соединяться исключительно одинаковые металлы (см. рис. «Контактная коррозия путем образования элементов»).
Внутрикристаллическая коррозия
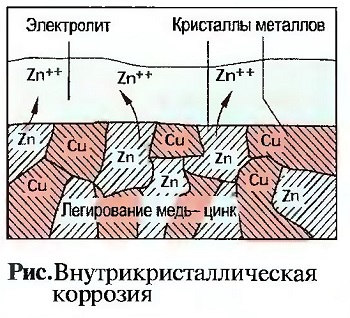 Кристаллы металлического материала, например легированного, такого как латунь, могут быть различны по химическому составу. Если при этом добавляется электролит, то между отдельными кристаллами возникает электрическое напряжение, как в гальваническом элементе. Кристаллы минусового полюса растворяются и структура материала разрушается. Этот вид коррозии называется внутрикристаллической коррозией (рис. «Внутрикристаллическая коррозия»). Она может равномерно появляться на поверхности. Если внутрикристаллическая коррозия появляется только в отдельных местах, то появляются воронкообразные кратеры и дырчатые повреждения.
Кристаллы металлического материала, например легированного, такого как латунь, могут быть различны по химическому составу. Если при этом добавляется электролит, то между отдельными кристаллами возникает электрическое напряжение, как в гальваническом элементе. Кристаллы минусового полюса растворяются и структура материала разрушается. Этот вид коррозии называется внутрикристаллической коррозией (рис. «Внутрикристаллическая коррозия»). Она может равномерно появляться на поверхности. Если внутрикристаллическая коррозия появляется только в отдельных местах, то появляются воронкообразные кратеры и дырчатые повреждения.
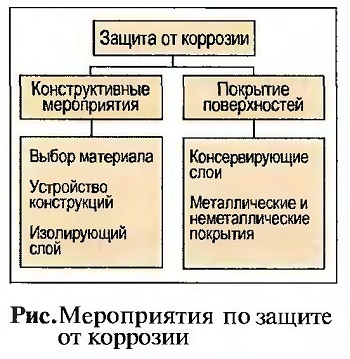 Коррозия вызывает большие повреждения. Поэтому принимаются меры, чтобы исключить коррозию, особенно у металлических материалов. Срок жизни строительных конструкций, как, например, металлических кровельных покрытий или водосточных желобов, зависит во многом от того, насколько можно уменьшить или исключить коррозию. Во всех методах защиты от коррозии пытаются исключить образования гальванического элемента (рис. «Мероприятия по защите от коррозии»).
Коррозия вызывает большие повреждения. Поэтому принимаются меры, чтобы исключить коррозию, особенно у металлических материалов. Срок жизни строительных конструкций, как, например, металлических кровельных покрытий или водосточных желобов, зависит во многом от того, насколько можно уменьшить или исключить коррозию. Во всех методах защиты от коррозии пытаются исключить образования гальванического элемента (рис. «Мероприятия по защите от коррозии»).
Конструктивные мероприятия по защите от коррозии металлов
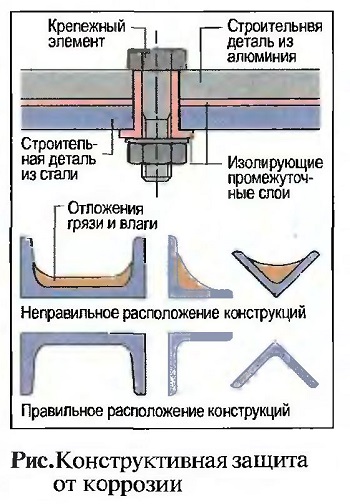 Под конструктивной защитой от коррозии понимают, например, соответствующий выбор материалов, чтобы исключить соприкосновение двух различных металлов во влажной среде, что можно обеспечить также с помощью изоляционного слоя. Далее можно за счет определенного положения конструкций исключить отложения грязи и влаги (рис. «Конструктивная защита от коррозии»). Арматура защищается от коррозии достаточно большим защитным слоем бетона.
Под конструктивной защитой от коррозии понимают, например, соответствующий выбор материалов, чтобы исключить соприкосновение двух различных металлов во влажной среде, что можно обеспечить также с помощью изоляционного слоя. Далее можно за счет определенного положения конструкций исключить отложения грязи и влаги (рис. «Конструктивная защита от коррозии»). Арматура защищается от коррозии достаточно большим защитным слоем бетона.
Защита от коррозии путем нанесения защитного покрытия
Конструкции могут защищаться от коррозии путем нанесения консервирующих слоев, путем нанесения неметаллических покрытий и металлических покрытий.
Консервирующие слои — это, например, окраска масляными красками, масляными лаками и лаками из синтетических смол. Перед нанесением окраски поверхности материалов должны быть тщательно очищены от ржавчины и других загрязнений. В стальных материалах образование ржавчины исключают защищающей от ржавчины окраской и покрывающей окраской, отталкивающей воду. В пустотных профилях коррозию можно исключить запечатыванием пустот.
Неметаллические покрытия — это по большей части толстые защитные слои, которые могут быть созданы путем нанесения синтетического материала или битума, например в нефтеналивных резервуарах и трубах для водоснабжения.
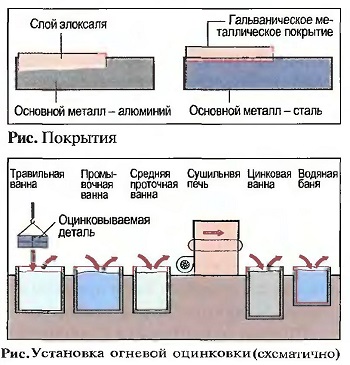 Заводские детали из алюминия и алюминиевых сплавов, как, например, дверные и оконные ручки, можно защитить от коррозии путем элоксации (элоксаль — электрически оксидированный алюминий). В противоположность гальваническим покрытиям слой элоксаля входит своими молекулами более чем на две трети своей толщины внутрь материала (рис. «Покрытия»). С помощью добавок в ванне с серной кислотой можно достичь различной окраски элоксированного слоя.
Заводские детали из алюминия и алюминиевых сплавов, как, например, дверные и оконные ручки, можно защитить от коррозии путем элоксации (элоксаль — электрически оксидированный алюминий). В противоположность гальваническим покрытиям слой элоксаля входит своими молекулами более чем на две трети своей толщины внутрь материала (рис. «Покрытия»). С помощью добавок в ванне с серной кислотой можно достичь различной окраски элоксированного слоя.
Металлические покрытия могут изготавливаться путем погружения в расплавленный металл (метод погружения в расплав), путем напыления жидкого металла или путем гальванической металлизации (гальванизации). В методе погружения в расплав детали погружаются в жидкий металл, как, например, в цинк при температуре 450 °С (огневая оцинковка). При этом тонкий слой покрывающего металла крепко удерживается на поверхности детали. Этот метод требует металлически чистых поверхностей. Поэтому детали должны быть предварительно обезжирены, а также очищены от ржавчины и окалины в травильных ваннах. Детали с огневой оцинковкой можно узнать по рисунку в виде снежинок на поверхности (рис. «Установка огневой оцинковки (схематично)»).
В стальных конструкциях металл покрытия может быть нанесен также напылением. При этом металл, поступающий в виде проволоки в распылитель, расплавляется газовой горелкой или электроэнергией, распыляется сжатым воздухом и наносится на деталь.