Химические соединения в строительстве
Различные атомы или элементы могут связываться между собой. Возникшее при этом новое вещество называют химическим соединением. Это новое вещество имеет совсем другие свойства, чем свойства элементов, из которых оно состоит. Вот о том, какими бывают химические соединения в строительстве, мы и поговорим в этой статье.
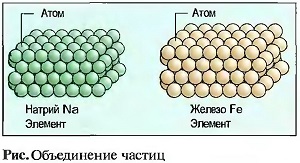
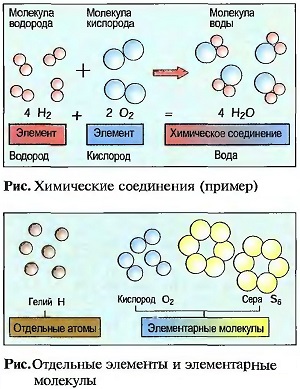 Например, соединяются один атом кислорода (О) с двумя атомами водорода (Н) в одну молекулу воды (Н20). Химическое соединение вода имеет другие свойства, чем элементы кислород и водород (рис. «Химические соединения (пример)» ). Одна молекула — это мельчайшая частичка химического соединения. Молекулы одного химического соединения одинаковы. У многих элементов определенное количество атомов объединено в молекулы. Их называют элементарными молекулами, например кислород с двумя, а сера с шестью атомами. Только у инертных газов, например у гелия, имеются отдельные атомы (рис. «Отдельные элементы и элементарные молекулы»). В металлических элементах атомы образуют кристаллоподобные соединения частичек (рис. «Объединение частиц»). Количество атомов одного элемента в молекуле показывается в виде индекса (низко расположенного числа) около краткого обозначения элемента, причем индекс 1 отсутствует.
Например, соединяются один атом кислорода (О) с двумя атомами водорода (Н) в одну молекулу воды (Н20). Химическое соединение вода имеет другие свойства, чем элементы кислород и водород (рис. «Химические соединения (пример)» ). Одна молекула — это мельчайшая частичка химического соединения. Молекулы одного химического соединения одинаковы. У многих элементов определенное количество атомов объединено в молекулы. Их называют элементарными молекулами, например кислород с двумя, а сера с шестью атомами. Только у инертных газов, например у гелия, имеются отдельные атомы (рис. «Отдельные элементы и элементарные молекулы»). В металлических элементах атомы образуют кристаллоподобные соединения частичек (рис. «Объединение частиц»). Количество атомов одного элемента в молекуле показывается в виде индекса (низко расположенного числа) около краткого обозначения элемента, причем индекс 1 отсутствует.
 ПРИМЕРЫ:
ПРИМЕРЫ:
- СН4 — одна молекула метана состоит из одного атома углерода и четырех атомов кислорода;
- NaCl — одна молекула хлорида натрия (поваренная соль) состоит из одной молекулы натрия и одной молекулы хлора.
При химических соединениях атомы связываются различным образом. Различают образование электронных пар, образование ионов и образование металлов.
Образование электронных пар
Элементы, атомы которых на своих электронных орбитах полностью укомплектованы по 8 электронов, не имеют склонности соединяться с другими элементами. Они находятся в стабильном состоянии (инертные Газы). Элементы, которые имеют только на 1 или 2 электрона меньше или больше 8 на своей внешней орбите, стремятся перейти в стабильное состояние, и поэтому очень активны в реакциях с другими элементами.
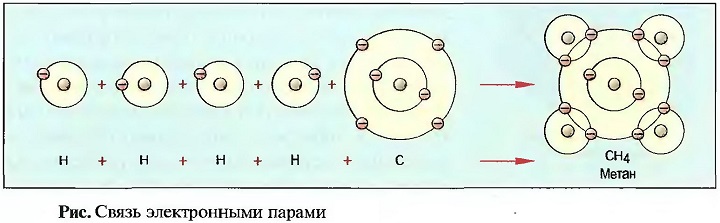
Если, например, 4 атома водорода и 1 атом углерода соединяются вместе, то каждый атом путем приема или отдачи одного электрона из атомной оболочки другого наполнить свою оболочку. Это происходит за счет того, что каждый электрон внешней орбиты оболочки атома будет использоваться совместно, а именно парами будут крутиться вокруг атомных ядер, и тем самым они будут связаны в одну молекулу метана. Так как связь возникает с помощью совместных электронных пар, то такой вид связи называют соединением электронными парами (рис. «Связь электронными парами» ).
Ионная связь
Если от атома отделяется один или несколько электронов, то его заряд становится положительным. Если, напротив, атом принимает электроны, то он становится электрически отрицательным.
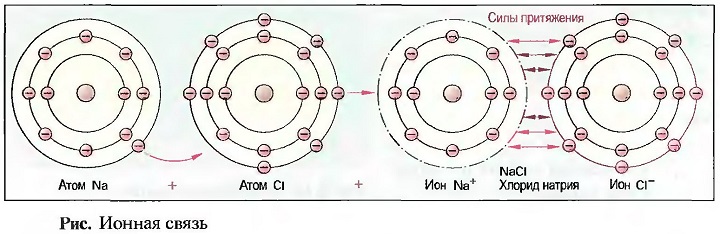
Возникшие при отдаче или приеме электронов положительные или отрицательные частички называют ИОНАМИ, причем знак заряда обозначается знаками «плюс» или «минус» справа сверху от краткого обозначения. Например, Na+ (положительно заряженный ион натрия) или Сl— (отрицательно заряженный ион хлора). Число зарядов обозначается цифрой рядом со знаком. Например, Аl3+ (троекратно положительно заряженный ион алюминия). 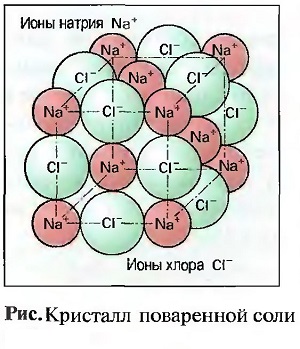 Ионы с противоположными зарядами притягиваются друг к другу и поэтому могут связываться друг с другом. При образовании хлорида натрия (поваренная соль), например, атом натрия отдает свой внешний электрон атому хлора (рис. «Ионная связь»). При этом получается положительно заряженный ион натрия и отрицательно заряженный ион хлора, которые за счет своих противоположных зарядов притягиваются друг к другу и образуют химическое соединение хлорид натрия. Эту связь называют ИОННОЙ СВЯЗЬЮ. Она имеет место в основном в соединениях металлов и неметаллов (соли). Силы притяжения при ионной связи действуют не только между двумя ионами, но и по всем направлениям. При этом получается решетчатое, ионное образование. Эта, построенная по геометрическим законам пространственная решетка, приводит к образованию прочных, ограниченных ровными плоскостями тел, называемых КРИСТАЛЛАМИ (ионная кристаллическая решетка) (рис. «Кристалл поваренной соли» ).
Ионы с противоположными зарядами притягиваются друг к другу и поэтому могут связываться друг с другом. При образовании хлорида натрия (поваренная соль), например, атом натрия отдает свой внешний электрон атому хлора (рис. «Ионная связь»). При этом получается положительно заряженный ион натрия и отрицательно заряженный ион хлора, которые за счет своих противоположных зарядов притягиваются друг к другу и образуют химическое соединение хлорид натрия. Эту связь называют ИОННОЙ СВЯЗЬЮ. Она имеет место в основном в соединениях металлов и неметаллов (соли). Силы притяжения при ионной связи действуют не только между двумя ионами, но и по всем направлениям. При этом получается решетчатое, ионное образование. Эта, построенная по геометрическим законам пространственная решетка, приводит к образованию прочных, ограниченных ровными плоскостями тел, называемых КРИСТАЛЛАМИ (ионная кристаллическая решетка) (рис. «Кристалл поваренной соли» ).
Соединения металлов
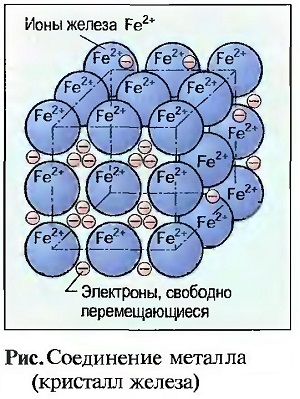 Атомы металлов обладают на их внешних орбитах в большинстве случаев только небольшим количеством электронов, которые при тесном расположении этих атомов отделяются от них с образованием прочного тела. При этом из атомов металлов получаются ионы металлов (рис. «Соединения металла (кристалл железа)» ). Электроны перемещаются подобно газу свободно между ионами металлов, которые можно представить себе, как шарообразные частички. За счет электрических сил сцепления они тесно прижимаются друг к другу, причем электроны удерживаются около них как на клею. Так как силы действуют во все стороны, то металлы образуют КРИСТАЛЛЫ (металлическая кристаллическая решетка).
Атомы металлов обладают на их внешних орбитах в большинстве случаев только небольшим количеством электронов, которые при тесном расположении этих атомов отделяются от них с образованием прочного тела. При этом из атомов металлов получаются ионы металлов (рис. «Соединения металла (кристалл железа)» ). Электроны перемещаются подобно газу свободно между ионами металлов, которые можно представить себе, как шарообразные частички. За счет электрических сил сцепления они тесно прижимаются друг к другу, причем электроны удерживаются около них как на клею. Так как силы действуют во все стороны, то металлы образуют КРИСТАЛЛЫ (металлическая кристаллическая решетка).
Валентность
Из каких элементов, и в каком соотношении эти элементы вступают в химические соединения, можно понять из химических формул. 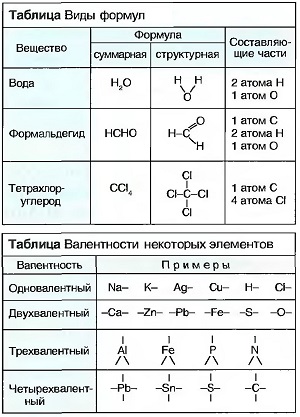 При этом различают суммирующие формулы и структурные формулы. В СУММАРНЫХ формулах краткие обозначения элементов в одном химическом соединении следуют одно за другим. Расположенные за краткими обозначениями внизу цифры показывают, в каком числовом соотношении содержатся атомы элементов в химическом соединении. В СУММАРНЫХ ФОРМУЛАХ каждый атом представлен отдельно. Они могут показывать порядок связи атомов в таких молекулах (табл. «Виды формул»). В каком числовом соотношении атомы вступают в химические соединения, зависит от того, сколько внешних электронов они могут отдать, принять или взять в совместное использование. Это число называют ВАЛЕНТНОСТЬЮ элемента, а обменные электроны называют ВАЛЕНТНЫМИ ЭЛЕКТРОНАМИ. В структурных формулах валентность обозначают числом валентных штрихов (табл. «Валентность некоторых элементов»).
При этом различают суммирующие формулы и структурные формулы. В СУММАРНЫХ формулах краткие обозначения элементов в одном химическом соединении следуют одно за другим. Расположенные за краткими обозначениями внизу цифры показывают, в каком числовом соотношении содержатся атомы элементов в химическом соединении. В СУММАРНЫХ ФОРМУЛАХ каждый атом представлен отдельно. Они могут показывать порядок связи атомов в таких молекулах (табл. «Виды формул»). В каком числовом соотношении атомы вступают в химические соединения, зависит от того, сколько внешних электронов они могут отдать, принять или взять в совместное использование. Это число называют ВАЛЕНТНОСТЬЮ элемента, а обменные электроны называют ВАЛЕНТНЫМИ ЭЛЕКТРОНАМИ. В структурных формулах валентность обозначают числом валентных штрихов (табл. «Валентность некоторых элементов»).
Химические уравнения
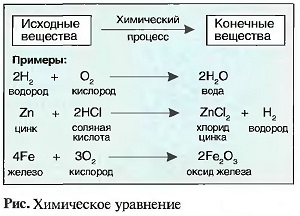 При химических процессах массы веществ перед химическим процессом равны массам материи после процесса. Химические процессы, называемые также химическими реакциями, можно представить в виде ХИМИЧЕСКИХ УРАВНЕНИЙ или уравнений реакций. В химических уравнениях знак равенства заменяется стрелкой. С левой стороны уравнения располагаются исходные материалы, справа — вещества, полученные после реакции (конечные вещества). Количество атомов слева от стрелки должно соответствовать количеству атомов справа от стрелки. Если расчет показывает, что необходимо выравнивание, это производится соответствующей цифрой перед кратким обозначением (рис. «Химические уравнения» ).
При химических процессах массы веществ перед химическим процессом равны массам материи после процесса. Химические процессы, называемые также химическими реакциями, можно представить в виде ХИМИЧЕСКИХ УРАВНЕНИЙ или уравнений реакций. В химических уравнениях знак равенства заменяется стрелкой. С левой стороны уравнения располагаются исходные материалы, справа — вещества, полученные после реакции (конечные вещества). Количество атомов слева от стрелки должно соответствовать количеству атомов справа от стрелки. Если расчет показывает, что необходимо выравнивание, это производится соответствующей цифрой перед кратким обозначением (рис. «Химические уравнения» ).
Синтез и анализ
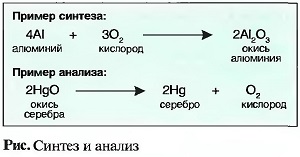 Под термином СИНТЕЗ понимают создание химического соединения. Получение синтетических материалов, например пластиков, является основной задачей химической промышленности. Разложение химических соединений на их элементы называют АНАЛИЗОМ. Синтез и анализ — это химические процессы. Они могут быть представлены химическими уравнениями (рис. «Синтез и анализ»).
Под термином СИНТЕЗ понимают создание химического соединения. Получение синтетических материалов, например пластиков, является основной задачей химической промышленности. Разложение химических соединений на их элементы называют АНАЛИЗОМ. Синтез и анализ — это химические процессы. Они могут быть представлены химическими уравнениями (рис. «Синтез и анализ»).
РЕКОМЕНДУЮ ЕЩЕ ПОЧИТАТЬ: