Химические элементы

Официальное определение гласит, что химическим элементом называется совокупность атомов с одинаковым зарядом атомных ядер. Для строительной химии такое определение вряд ли подойдет, так как, чтобы понять его необходимо углубиться в изучение химии. Мы же рассматриваем это понятие, с точки зрения применимости к строительной индустрии. Поэтому, давайте определим понятие химического элемента проще. Вещества, которые не могут больше быть разложены на отдельные элементы, называют химическими элементами или основными веществами.
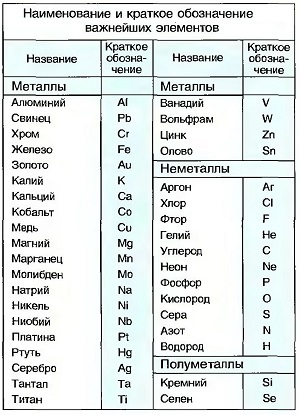 На сегодня нам известны 92 природных элемента, из которых состоят все вещества на нашей планете. 17 элементов получены искусственным путем. Что касается природных элементов, то 66 из них — металлы, 16 — неметаллы и 6 —полуметаллы. Металлы блестят и являются хорошими проводниками электрического тока и тепла. Неметаллы в основном газообразные, преимущественно диэлектрики и плохие проводники тепла, как, например, сера. Полуметаллы могут иметь как металлические, так и неметаллические свойства, как, например, кремний или селен. Все химические элементы обозначаются краткими обозначениями, которые являются производными от их греческого или латинского названия (табл. «Наименование и краткое обозначение важнейших элементов»).
На сегодня нам известны 92 природных элемента, из которых состоят все вещества на нашей планете. 17 элементов получены искусственным путем. Что касается природных элементов, то 66 из них — металлы, 16 — неметаллы и 6 —полуметаллы. Металлы блестят и являются хорошими проводниками электрического тока и тепла. Неметаллы в основном газообразные, преимущественно диэлектрики и плохие проводники тепла, как, например, сера. Полуметаллы могут иметь как металлические, так и неметаллические свойства, как, например, кремний или селен. Все химические элементы обозначаются краткими обозначениями, которые являются производными от их греческого или латинского названия (табл. «Наименование и краткое обозначение важнейших элементов»).
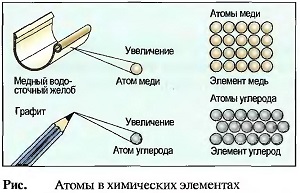
Химические элементы состоят из атомов. Атомы определенных элементов, как мы уже рассмотрели выше, имеют одинаковый заряд, т.е. похожи друг на друга. Поэтому различные свойства элементов объясняются различным строением их атомов (рис. «Атомы в химических элементах»).
Атомы
Атомы, это мельчайшие частички материи, расчленение которых невозможно физическими или химическими методами. Атомы настолько малы, что они невидимы. Поэтому строение атомов и процессы, происходящие в атомах, люди представляют с помощью моделей. Согласно модели, которую представил датский естествоиспытатель Нильс Бор (1885—1962) атомы имеют шарообразное строение и состоят из оболочки атома и атомного ядра (см. рис. «Атомы в химических элементах»).
 |
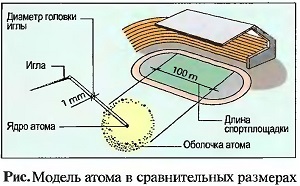 |
- Диаметр атомной оболочки — 0,0000001 мм.
- Диаметр атомного ядра — 0,000000000001 мм (рис. «Модель атома в сравнительных размерах»).
Атомное ядро

- Находится в центре атома.
- Заключает в себе почти всю массу атома.
- Состоит из нуклонов или кирпичиков атомного ядра.
Нуклоны подразделяются на протоны, заряженные положительным электрическим зарядом, и нейтроны, которые электрически нейтральны. Ядра атомов могут состоять из нескольких протонов и нейтронов (рис. «Строение атомного ядра»).
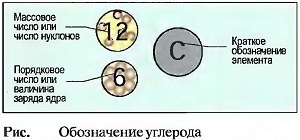
- Массовое число или число нуклонов равно числу протонов и нейтронов в атоме.
- Порядковое число или величина заряда ядра равно числу протонов в атомном ядре.
Атом гелия или элемент гелий имеет порядковое число 2 и массовое число 4. Атом углерода или элемент углерод имеет порядковое число 6 и массовое число 12 (рис. «Обозначение углерода»).
Оболочка атома
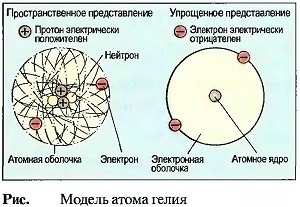 Оболочка атома образована электронами. Они вращаются с большой скоростью в шарообразной области вокруг атомного ядра. Эту область называют электронной оболочкой атома (рис. «Модель атома гелия»).
Оболочка атома образована электронами. Они вращаются с большой скоростью в шарообразной области вокруг атомного ядра. Эту область называют электронной оболочкой атома (рис. «Модель атома гелия»).
Электроны имеют отрицательный электрический заряд и обладают очень малой массой. По величине отрицательный заряд соответствует положительному заряду протонов в ядре атома. В атоме число электронов и протонов одинаково, атом по отношению к внешней среде является электрически нейтральным. С помощью противоположных по знаку зарядов электроны удерживаются на своих орбитах.
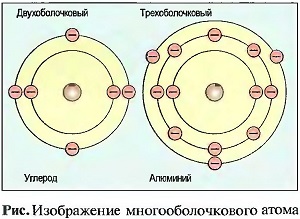 Электроны группируются в электронные оболочки, которых вокруг ядра может быть до семи. Они находятся от ядра на различных расстояниях. В каждой электронной оболочке может быть определенное максимальное число электронов. Во внутренней оболочке может быть 2 электрона, во второй — 8, в третьей — 18, однако во внешней оболочке их может быть тоже 8 (рис. «Изображение много оболочного атома»).
Электроны группируются в электронные оболочки, которых вокруг ядра может быть до семи. Они находятся от ядра на различных расстояниях. В каждой электронной оболочке может быть определенное максимальное число электронов. Во внутренней оболочке может быть 2 электрона, во второй — 8, в третьей — 18, однако во внешней оболочке их может быть тоже 8 (рис. «Изображение много оболочного атома»).
Атомная масса
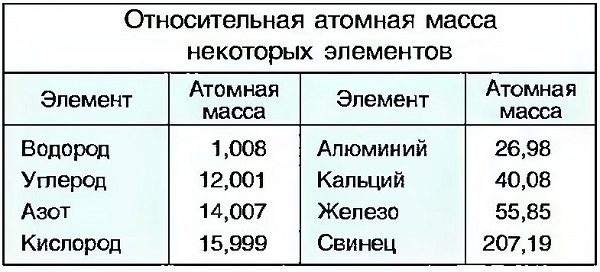
При определении атомной массы очень малая масса электронов не учитывается. Масса атома водорода или протона составляет 1,67·10-24 г. Эта величина очень мала. Поэтому ее заменяют числом 1,008 или 1. Так как масса протона равна массе нейтрона, то атомная масса других элементов во много раз больше этого числа. Поэтому ее называют относительной атомной массой или массовым числом. Относительная атомная масса атома кислорода с 16 нуклонами составляет 15,999 или 16 (табл. «Относительная атомная масса некоторых элементов»).
При одинаковом количестве атомов какого-либо элемента, а именно при 6,02205·1023 (1 Моль), относительная атомная масса соответствует его атомной массе в граммах (молярная масса).
Изотопы
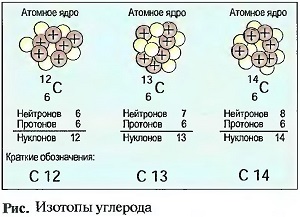 Атомы определенного элемента, например углерода, имеют одинаковое число протонов. Однако число нейтронов может быть разным (рис. «Изотопы углерода»). Атомы одного и того же элемента с разным количеством нейтронов называют изотопами.
Атомы определенного элемента, например углерода, имеют одинаковое число протонов. Однако число нейтронов может быть разным (рис. «Изотопы углерода»). Атомы одного и того же элемента с разным количеством нейтронов называют изотопами.
Изотопы, например, углерода имеют одинаковые химические свойства, но разные массы. Почти все элементы образуют изотопы, но только в ограниченном количестве.
Радиоактивность
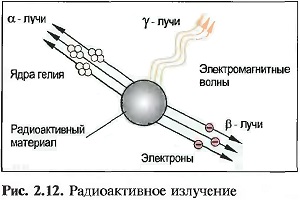 Изотопы некоторых элементов, например радия (Ra 226), урана (U 235), углерода (С 14), излучают энергию. При этом атомные ядра распадаются. Это свойство называется радиоактивностью. При этом различают альфа-, бета- и гамма-лучи (рис. «Радиоактивное излучение»). Альфа-лучи состоят из ядер гелия. Состоящие из электронов бета-лучи пронизывают стальные листы или свинцовые пластины толщиной до 1 мм. Гамма-лучи с очень малой длиной волны возникают при превращениях ядра. Они проникают через бетонные стены толщиной в метр и могут быть остановлены только очень толстыми свинцовыми листами. Они очень опасны для человека и приводят к разрушению тканей.
Изотопы некоторых элементов, например радия (Ra 226), урана (U 235), углерода (С 14), излучают энергию. При этом атомные ядра распадаются. Это свойство называется радиоактивностью. При этом различают альфа-, бета- и гамма-лучи (рис. «Радиоактивное излучение»). Альфа-лучи состоят из ядер гелия. Состоящие из электронов бета-лучи пронизывают стальные листы или свинцовые пластины толщиной до 1 мм. Гамма-лучи с очень малой длиной волны возникают при превращениях ядра. Они проникают через бетонные стены толщиной в метр и могут быть остановлены только очень толстыми свинцовыми листами. Они очень опасны для человека и приводят к разрушению тканей.
Радиоактивные материалы применяют в технике, например для контроля толщины материала при изготовлении бумаги, фольги, пленок и листовых металлических материалов.
Периодическая система элементов
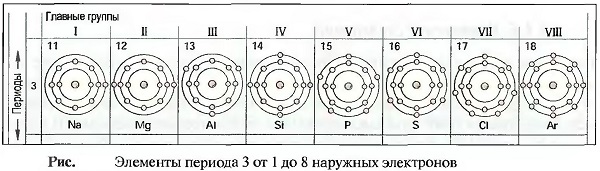
Если исследовать свойства элементов в порядке их атомных зарядов, то можно заметить, что почти одинаковые свойства периодически повторяются через 8 элементов. При этом получается 7 строчек или периодов. Период 3, например, объединяет элементы от натрия до аргона (рис. «Элементы периода 3 от 1 до 8 наружных электронов»).
Если расположить 7 периодов так, что элементы с одинаковыми свойствами будут стоять одни под другими, то получится 8 вертикальных колонок или главных групп от I до VIII (табл. «Периодическая система элементов»)
Расположение элементов по их свойствам в 7 горизонтальных периодов и 8 вертикальных колонок или главных групп называется периодической системой элементов, созданной русским ученым Д.И. Менделеевым. О том, сколько работал Дмитрий Иванович Менделеев над своей таблицей, можно почитать здесь.
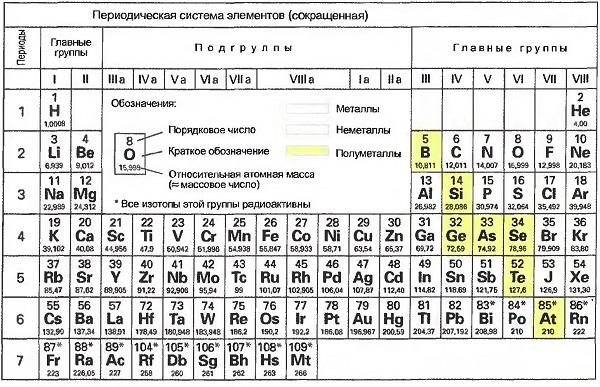
Было установлено, что элементы главных групп содержат на внешней электронной орбите каждый раз от 1 до 8 электронов. Элементы главной группы 1 имеют всегда 1 внешний электрон. Они все — металлы, за исключением водорода, и сильно реагируют с неметаллами, как, например, кислород или хлор. Элементы главной группы VIII имеют на внешней орбите по 8 электронов. Они при комнатной температуре газообразные и не соединяются с другими элементами (инертные газы). Металлы находятся в левой части периодической системы, неметаллы — в правой. Между ними расположены полуметаллы. Периодическая система четко показывает, что свойства элементов зависят от количества электронов на их внешних орбитах.
Атомы элементов в подгруппах имеют 1 или 2 внешних электрона и различаются по количеству электронов на их внутренних орбитах. Свойства элементов в подгруппах имеют большое сходство, все они металлы (см. табл. «Периодическая система элементов»).
РЕКОМЕНДУЮ ЕЩЕ ПОЧИТАТЬ: